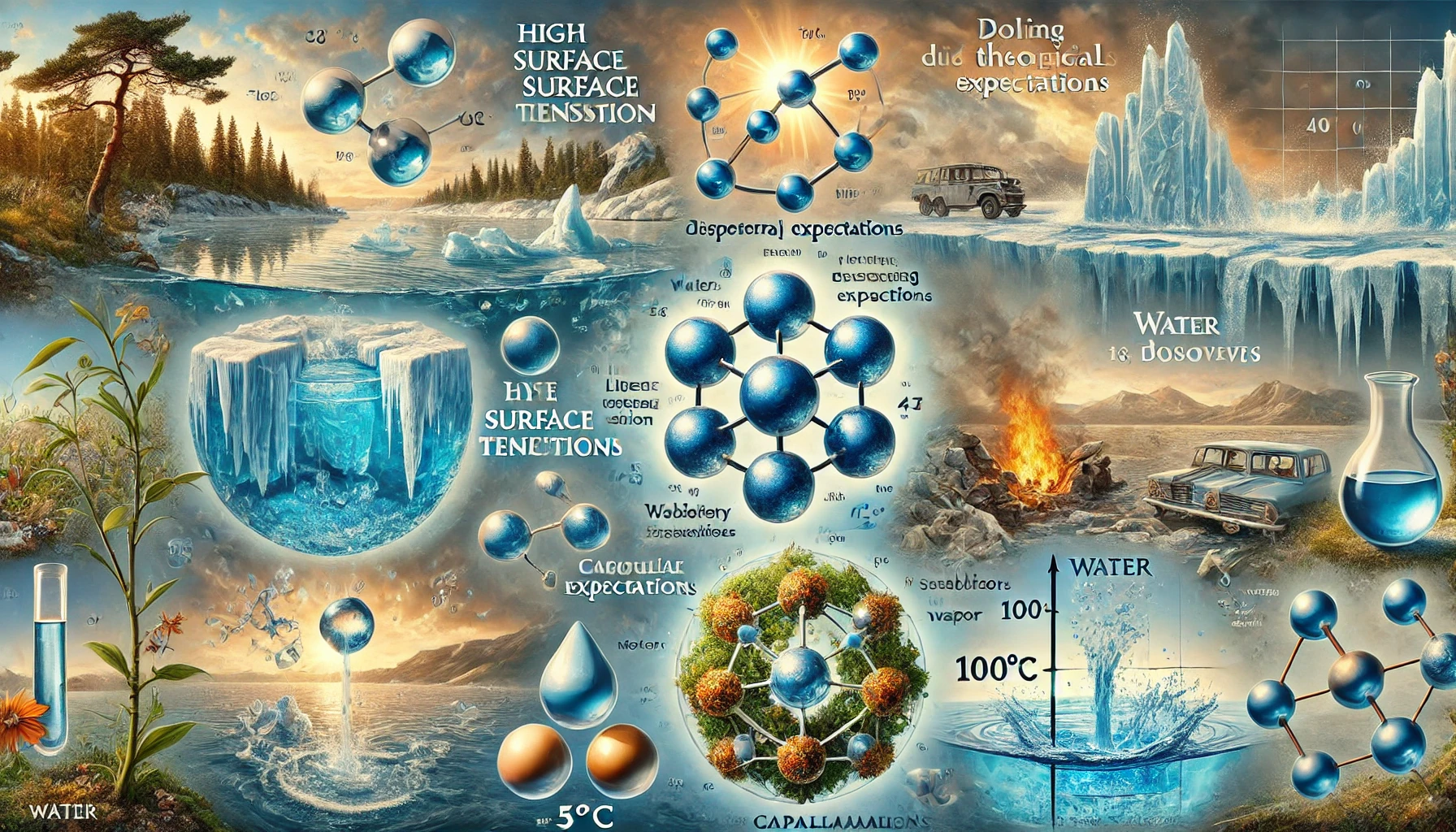
Les Singularités de l’Eau : Un Élément d’Exception

Wilfried Hacheney, physicien allemand, résume bien l’énigme que représente l’eau : « Un scientifique honnête devrait admettre qu'il ne sait pas ce qu'est l'eau en réalité. » Malgré sa formule chimique simple (H₂O), l’eau ne cesse de défier les lois physiques et chimiques connues, et présente des propriétés uniques ou rarissimes. Ces singularités font d’elle un sujet d’étonnement constant pour les chercheurs, à l’instar de Yann Olivaux et des scientifiques allemands Josef Zerluth et Michael Gienger.
Les Singularités Physiques de l’Eau

-
Densité maximale à 4°C :
Contrairement à la plupart des substances, l’eau atteint sa densité maximale à 4°C, et non à sa température de congélation (0°C). Cette particularité permet à la glace de flotter sur l’eau, car la glace est moins dense que l’eau liquide. Résultat : les lacs et rivières gèlent par le haut, protégeant ainsi la vie aquatique en dessous. -
Augmentation de volume lors de la solidification :
Lorsque l’eau se transforme en glace, son volume augmente d’environ 8 %, une caractéristique unique parmi les liquides. Ce phénomène est à l’origine de la flottabilité de la glace et de pressions importantes (jusqu’à 207 000 KPa), capables de fissurer des roches ou des infrastructures. -
Étonnants points de fusion et d’ébullition :
Selon les lois classiques, l’eau devrait fondre à -120°C et bouillir à -100°C. Pourtant, elle se liquéfie à 0°C et entre en ébullition à 100°C. Ces anomalies démontrent des propriétés spécifiques dues aux interactions moléculaires (ponts hydrogène). -
Point critique à 374°C :
Le point critique réel de l’eau est situé à 374°C, bien au-delà de ce que prédisent les modèles physiques. Cette résistance exceptionnelle à la vaporisation en fait un fluide idéal pour le transport thermique. -
Viscosité changeante :
L’eau se distingue par une viscosité qui augmente rapidement à basse température et diminue sous l’effet de la pression, comportement inhabituel comparé aux autres liquides.
Les Singularités Thermiques

-
Capacité calorifique élevée :
L’eau absorbe et libère de la chaleur plus lentement que tout autre liquide courant, à l’exception de l’ammoniac (NH₃). Pour augmenter de 1°C la température d’un litre d’eau, 1 000 calories sont nécessaires. Ce pouvoir calorifique quadruple celui de l’air, et confère à l’eau une grande inertie thermique, essentielle pour stabiliser les climats et les écosystèmes. -
Conductivité thermique :
L’eau possède la plus haute conductivité thermique parmi les liquides usuels, permettant un transfert de chaleur efficace, vital pour la régulation thermique des organismes vivants. -
Tension superficielle remarquable :
La tension superficielle de l’eau est dix fois supérieure à ce que prédisent les lois théoriques. Cette propriété explique la forme sphérique des gouttes d’eau et la montée capillaire qui permet aux plantes d’acheminer l’eau jusqu’à leurs feuilles.
Les Singularités Chimiques

-
Solvant universel :
L’eau dissout plus de substances que tout autre liquide, ce qui en fait un solvant puissant et indispensable pour les réactions chimiques biologiques et géologiques. Cependant, cette capacité empêche de l’obtenir à l’état totalement pur, même en laboratoire. -
Stabilité dans les réactions chimiques :
L’eau participe activement à de nombreuses réactions chimiques sans être altérée. Elle joue ainsi un rôle central dans les cycles biogéochimiques tout en maintenant son intégrité moléculaire. -
Structure moléculaire dynamique :
Les molécules d’eau s’organisent en clusters, des structures éphémères qui se forment et se brisent en picosecondes (10⁻¹² s). Cette fluidité confère à l’eau ses propriétés dynamiques uniques.
Les Quatre Points Critiques de l’Eau

Selon les études de Viktor Schauberger et Bartholomew, l’eau présente quatre points de transition majeurs où ses propriétés changent radicalement :
-
0°C (point de congélation) :
L’eau passe de l’état liquide à l’état solide. La structure de ses liaisons hydrogène devient stable, ce qui lui confère une rigidité particulière. -
4°C (densité maximale) :
À cette température, l’eau atteint son potentiel énergétique optimal. Sa structure est à son pic d’organisation, semblable à un colloïde géant, selon les travaux du Pr. G. Piccardi. -
35°C (chaleur spécifique minimale) :
Entre 4°C et 35°C, la structure de l’eau devient moins organisée. À 35°C, elle perd ses propriétés colloïdales, marquant une transition significative dans ses comportements thermiques. -
100°C (point d’ébullition) :
L’eau se transforme en vapeur. Sa densité diminue drastiquement et son volume augmente de 1 725 fois, ce qui en fait un fluide idéal pour les systèmes industriels.
En Résumé : L’Eau, Une Substance Paradoxale

L’eau défie les lois scientifiques par ses anomalies thermiques, ses propriétés dynamiques et sa complexité structurelle. Ces singularités font d’elle un élément essentiel à la vie, aux écosystèmes et aux activités humaines. Ses caractéristiques uniques, comme sa capacité calorifique élevée, son comportement anormal lors de la congélation, et son rôle de solvant universel, rappellent son statut d'exception dans le monde physique et chimique.
En dépit des avancées scientifiques, l’eau reste une énigme. Comme le dit Martin Chaplin, avec ses 63 anomalies recensées, l’eau continue de fasciner et d’échapper à une compréhension complète.